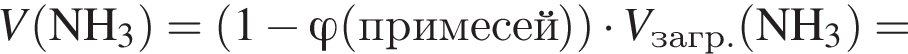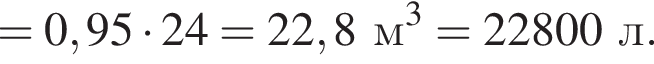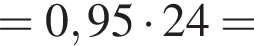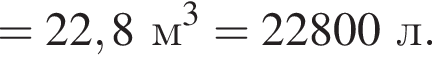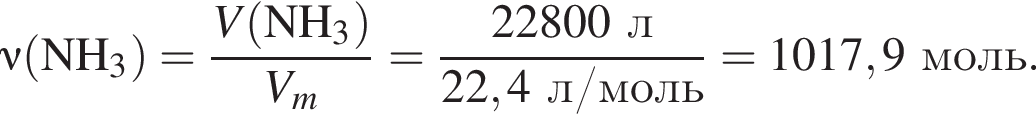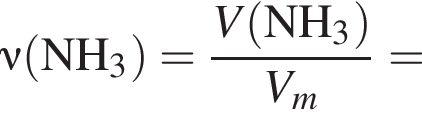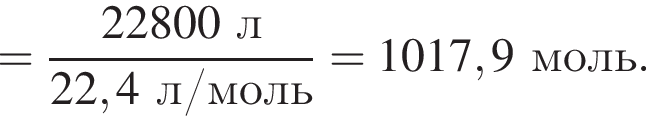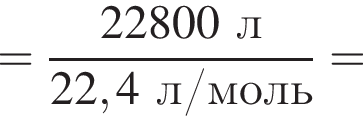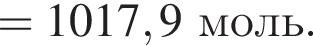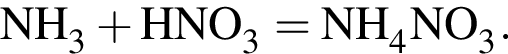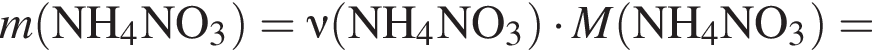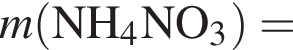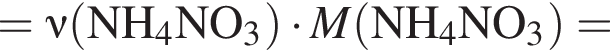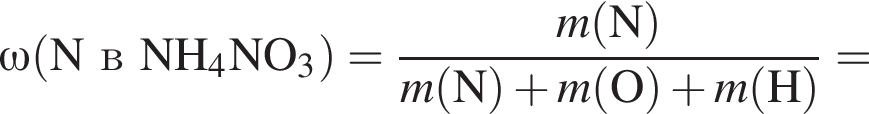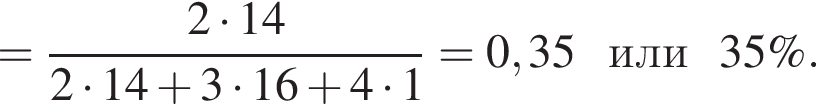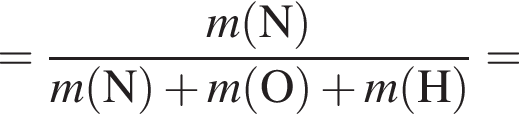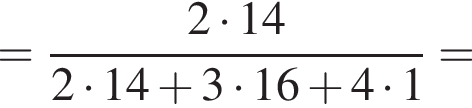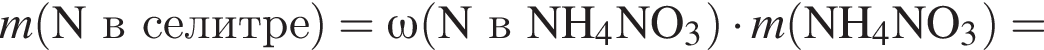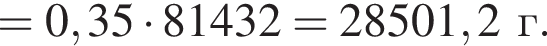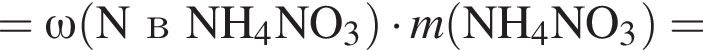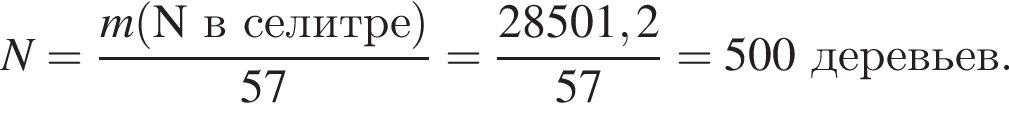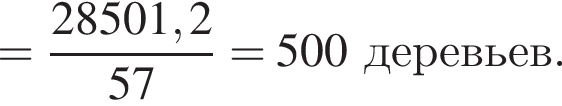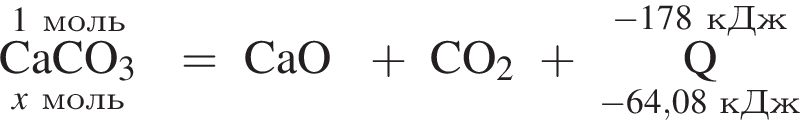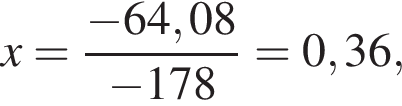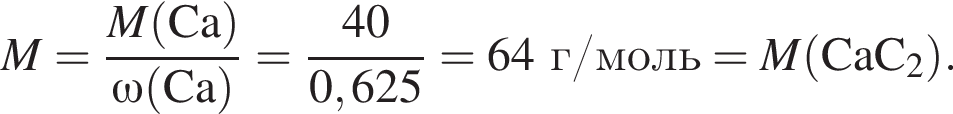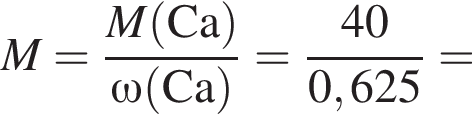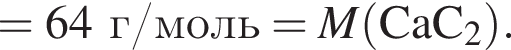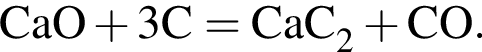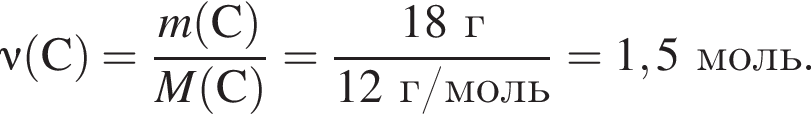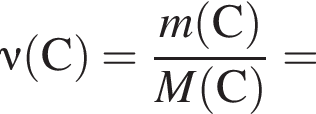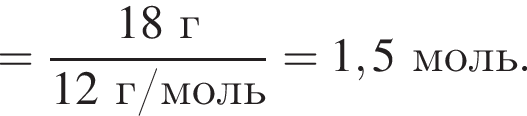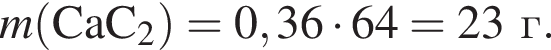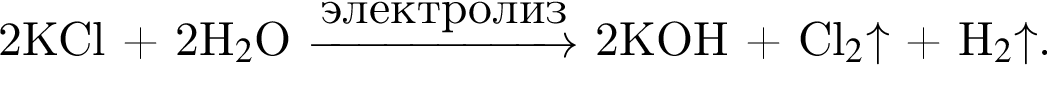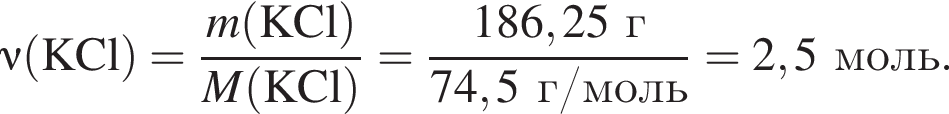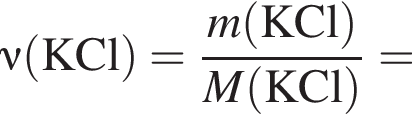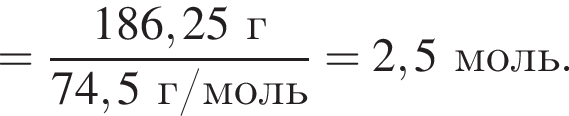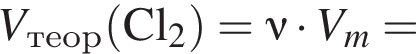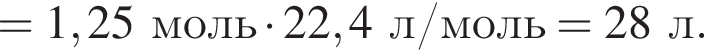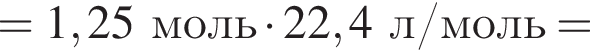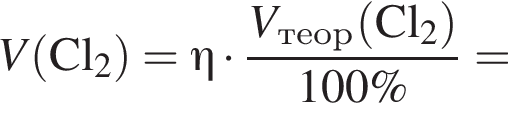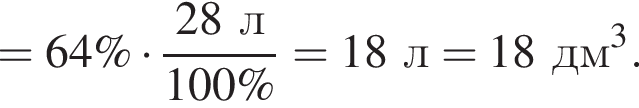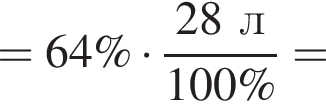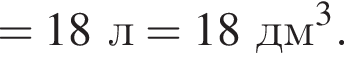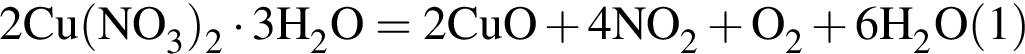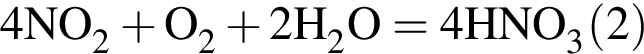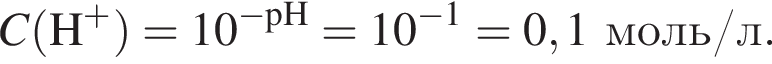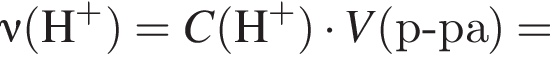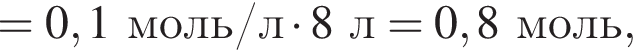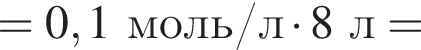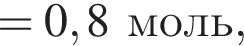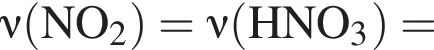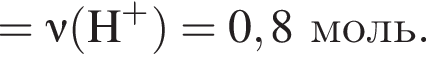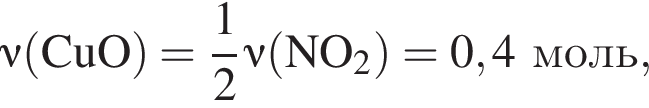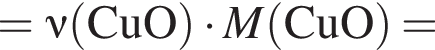Укажите символ химического элемента:
Дана электронно-графическая схема атома химического элемента:
Число протонов в ядре атома этого элемента равно:
Установите соответствие между электронной конфигурацией внешнего энергетического уровня атома (иона) в основном состоянии и названием частицы.
1 — 2s22p1
2 — 4s24p3
3 — 5s25p6
а — атом мышьяка
б — иодид-ион
в — катион рубидия
г — атом селена
д — атом бора
Как ковалентная полярная, так и ионная связь присутствует в веществе:
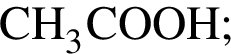
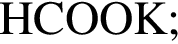
Ковалентная связь имеется во всех веществах ряда:
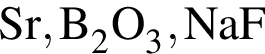
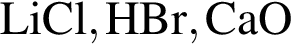
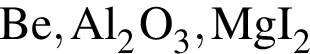
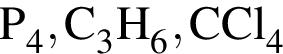
Степень окисления +2 имеют атомы кислорода в соединении:
Укажите ряд, в котором оба гидроксида можно получить растворением соответствующего металла в воде:
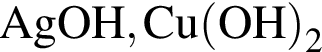
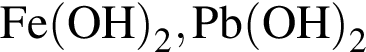
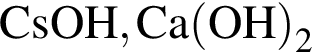
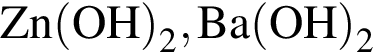
Укажите ряд химических элементов, каждый из которых образует оксид состава ![]() и гидроксид состава
и гидроксид состава 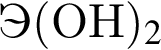 :
:
Разбавленный водный раствор гидроксида калия при комнатной температуре (20 °C) может реагировать с каждым веществом пары:
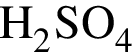 и
и  и
и 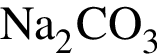
Число кислот из приведенных — соляная, угольная, бромоводородная, сероводородная, сернистая, которые можно получить растворением газообразного (н. у.) вещества в воде, равно:
Двухосновная бескислородная кислота образуется при взаимодействии в водном растворе веществ:
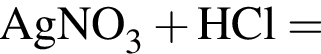
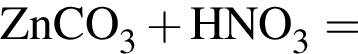
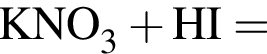
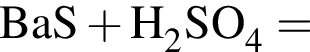
В сосуд, содержащий 2 дм3 воды, добавили 1 моль 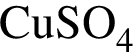 и 1 моль
и 1 моль ![]() В результате выпал осадок. Масса осадка уменьшится, если в этот сосуд добавить:
В результате выпал осадок. Масса осадка уменьшится, если в этот сосуд добавить:
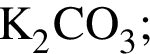

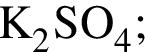
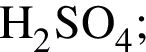
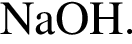
Используя в качестве реагента только разбавленную серную кислоту, в одну стадию НЕВОЗМОЖНО осуществить превращение:


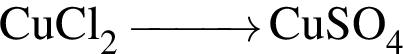
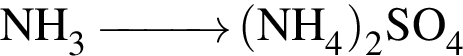
Укажите практически осуществимые реакции (все электролиты взяты в виде разбавленных водных растворов):
а — 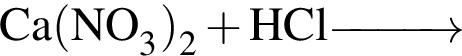
б — 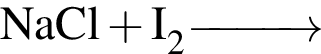
в — 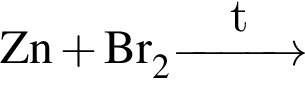
г — 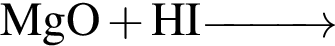
В отличие от разбавленной концентрированная серная кислота:
а) вытесняет ![]() из твёрдого
из твёрдого ![]() ;
;
б) НЕ реагирует с медью;
в) реагирует с  ;
;
г) при взаимодействии с цинком НЕ образует водород.
Разбавленная фосфорная кислота вступает в реакции соединения с веществами:
a — ![]()
б — ![]()
в — 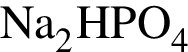
г — ![]()
Очистить угарный газ от углекислого можно с помощью водных растворов веществ:
а — 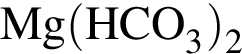
б — ![]()
в — 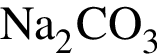
г — 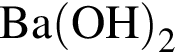
Выберите правильное утверждение:
Наибольшее количество водорода выделится при действии избытка соляной кислоты на смесь массой 100 г, состоящую из металлов пары (массовые доли металлов равны):
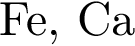
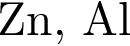
Разбавленная серная кислота реагирует с веществами (электролиты взяты в виде водных растворов):
а — ![]()
б — 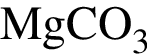
в — ![]()
г — 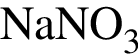
В закрытом сосуде постоянного объёма установилось равновесие

Затем температуру повысили. Для новой равновесной системы по сравнению с первоначальной верными являются утверждения:
а) давление в системе увеличилось;
б) количество иодоводорода уменьшилось;
в) количество иода уменьшилось;
г) давление в системе НЕ изменилось.
О протекании химических процессов в водном растворе свидетельствует:
Число возможных попарных взаимодействий в разбавленном водном растворе между ионами 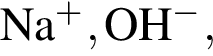
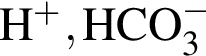 равно:
равно:
Выберите утверждение, верно характеризующее соединение, формула которого представлена на рисунке:
1 — молекула является плоской;
2 — число атомов водорода в молекуле равно 7;
3 — соответствует общей формуле 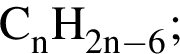
4 — является гомологом соединения
5 — является изомером бензола.
Сумма молярных масс органических веществ X и Y схемы превращений
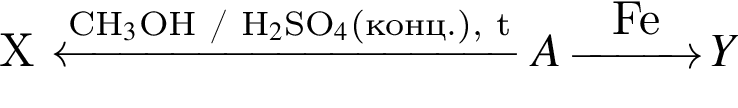
Для окислительно-восстановительной реакции 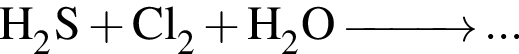 верными являются схемы перехода электронов:
верными являются схемы перехода электронов:
а) 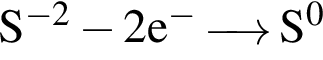
б) 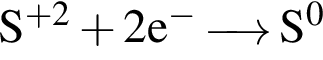
в) 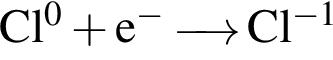
г) 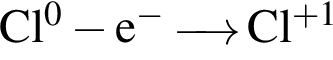
Соединение, формула которого относится к классу:
Из соединения, формула которого
индивидуальные аминокислоты можно получить в результате реакции:
Установите соответствие между формулой органического вещества и названием его структурного изомера.
1 — гептин-2
2 — 2-метилпентен-1
3 — гексен-3
4 — гексин-3
5 — 2-метилбутан
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: АЗБ1В2Г2. Помните, что некоторые данные правого столбца могут использоваться несколько раз.
Установите соответствие между органическим веществом и его изомером.
А) 2-метилпропанол-2
Б) гексен-1
В) пропадиен
Г) метилпропионат
1) бутановая кислота
2) бутанол-1
3) пропин
4) бутаналь
5) гексен-2
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А2Б1B3Г4.
При окислении альдегида массой 8,8 г, содержащего одну альдегидную группу, избытком аммиачного раствора оксида серебра(I) образовалось серебро массой 43,2 г. Рассчитайте массу (г) полученной одноосновной кислоты.
Массовая доля триглицерида, образованного остатками пальмитиновой и стеариновой кислот в мольном отношении 1 : 2, в некотором жире составляет 24%. Чему равна общая масса (кг) пальмитата и стеарата натрия, полученных в результате омыления данного жира массой 960 кг (выход считайте 100%)? (Считайте, что все остатки пальмитиновой и стеариновой кислот входят в состав указанного триглицерида.)
В четырех пронумерованных пробирках находятся органические вещества.
О них известно следующее:
— в пробирке № 1 — кристаллическое вещество, плохо растворимое в холодной воде;
— в пробирке № 2 находится жидкость (20 °C), которая смешивается с водой в любых соотношениях и вступает в реакцию с  с выделением газа;
с выделением газа;
— вещества в пробирках № 1, № 3 и № 4 вступают в реакцию с бромной водой, при этом в пробирках № 1 и № 4 образуются осадки белого цвета.
Установите соответствие между названием органического вещества и номером пробирки, в которой находится указанное вещество.
А) анилин
Б) фенол
В) гексен-1
Г) уксусная кислота
1
2
3
4
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А1Б4B2ГЗ.
Установите соответствие между схемой обратимой реакции и направлением смещения равновесия при увеличении давления.
А) 
Б) 
В) 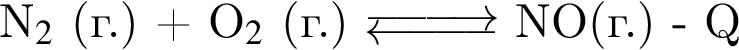
Г) 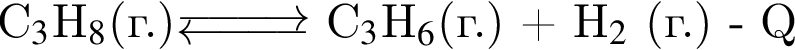
1 — вправо (в сторону продуктов)
2 — влево (в сторону исходных веществ)
3 — НЕ смещается
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А1Б2ВЗГЗ.
Плотность по аргону паров бромида и фторида оного и того же химического элемента равна 8,60 и 2,50 соответственно. В бромиде и фториде этот элемент находится в одинаковой степени окисления. Найдите число атомов в молекуле данного фторида.
Ответ запишите одной цифрой, например: 5.
К раствору серной кислоты массой 300 г с массовой долей 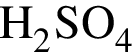 16% прибавили раствор иодида бария массой 100 г. При этом массовая доля серной кислоты растворе уменьшилась до 9%. Рассчитайте массовую долю (%)
16% прибавили раствор иодида бария массой 100 г. При этом массовая доля серной кислоты растворе уменьшилась до 9%. Рассчитайте массовую долю (%) ![]() в добавленном растворе.
в добавленном растворе.
Определите сумму молярных масс (г/моль) азотсодержащих веществ ![]() и
и ![]() образовавшихся в результате превращений, протекающих по схеме (
образовавшихся в результате превращений, протекающих по схеме (![]() и
и ![]() — вещества немолекулярного строения)
— вещества немолекулярного строения)
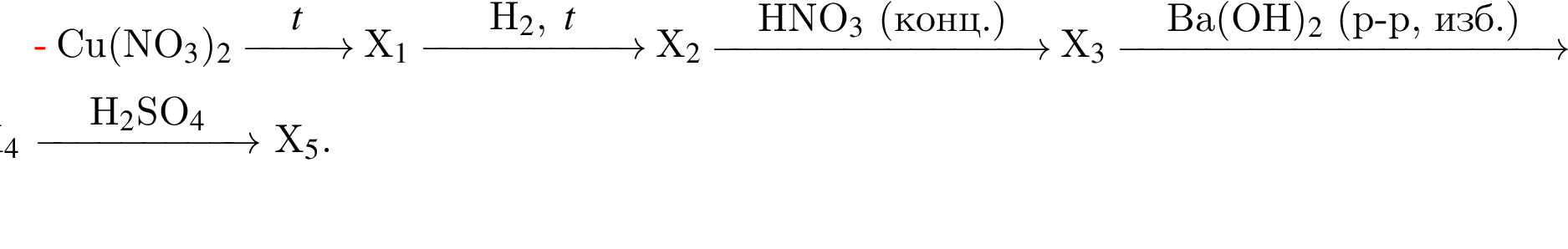
Установите соответствие между схемой химической реакции, протекающей в водном растворе, и суммой коэффициентов в сокращенном ионном уравнении реакции.
А) 
Б) 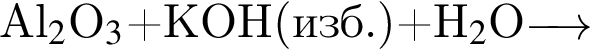
В) 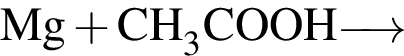
Г) 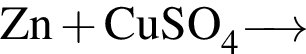
1) 3
2) 4
3) 5
4) 6
5) 7
6) 12
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А2Б3В5Г1.
Расставьте коэффициенты методом электронного баланса в уравнении окислительно- восстановительной реакции, схема которой
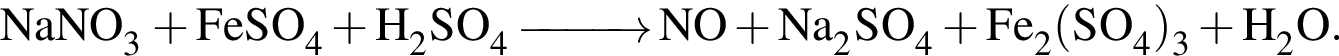
Укажите сумму коэффициентов перед веществами молекулярного строения.
Смесь азота с водородом при нагревании пропустили над катализатором. В результате реакции с выходом 70% был получен аммиак, а содержание водорода в полученной газовой смеси составило 68% по объему. Рассчитайте массовую долю (%) водорода в исходной газовой смеси.
Загрязненный аммиак объемом 24 м3 (н. у.) содержит 5% примесей (по объему). В результате поглощения всего аммиака избытком азотной кислоты была получена аммиачная селитра. Учитывая, что для подкормки одного плодового дерева необходимо 57 г химического элемента азота, рассчитайте, какое количество деревьев можно подкормить, используя полученную селитру.
Тепловой эффект реакции образования карбоната кальция из оксидов составляет 178 кДж/моль. Для полного разложения некоторого количества карбоната кальция потребовалось 64,08 кДж теплоты. Полученный оксид кальция спекали с углем массой 18 г в электропечи. Вычислите массу (г) образовавшегося при этом бинарного соединения, в котором массовая доля кальция равна 62,5%. (Примесями пренебречь.)
Электролиз водного раствора, содержащего хлорид калия массой 186,25 г, протекает по схеме
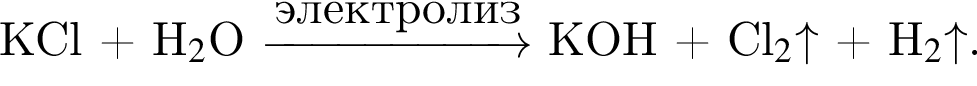
Рассчитайте объем (н. у., дм3) выделившегося в результате реакции хлора, если его выход составляет 64%.
Порцию кристаллогидрата соли 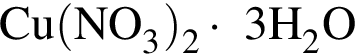 прокалили. Образовался черный порошок, а остальные продукты реакции были полностью поглощены водой. Образовавшийся раствор сильной кислоты объемом 8 дм3 имеет
прокалили. Образовался черный порошок, а остальные продукты реакции были полностью поглощены водой. Образовавшийся раствор сильной кислоты объемом 8 дм3 имеет ![]() Рассчитайте массу (г) черного порошка.
Рассчитайте массу (г) черного порошка.

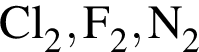 являются молекулами, а не символами. Символы химических элементов представлены в таблице Менделеева.
являются молекулами, а не символами. Символы химических элементов представлены в таблице Менделеева.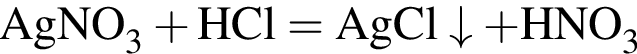
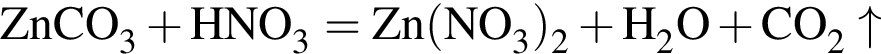
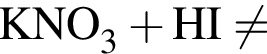
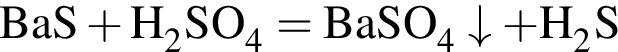
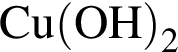 количеством 0,5 моль:
количеством 0,5 моль: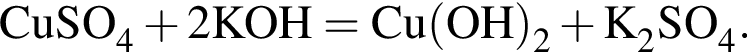
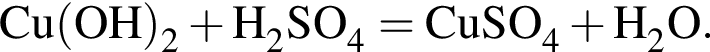
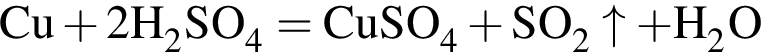 );
);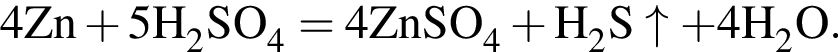
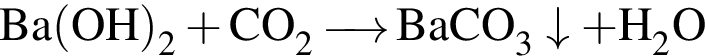 .
.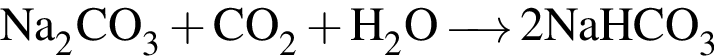 .
.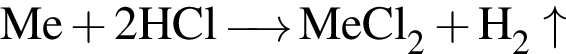 .
.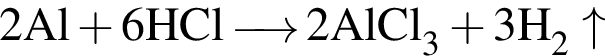
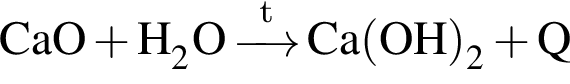 .
.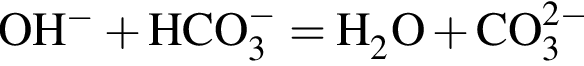
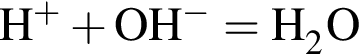
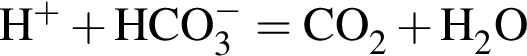
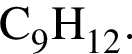
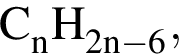 так как
так как 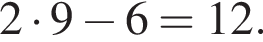
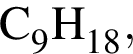 соединения отличаются количеством только атомов водорода и относятся к разным классам, поэтому утверждение неверно.
соединения отличаются количеством только атомов водорода и относятся к разным классам, поэтому утверждение неверно.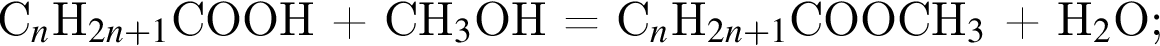
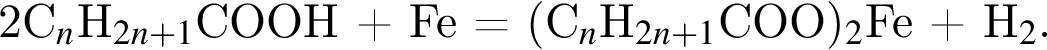
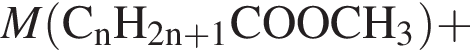
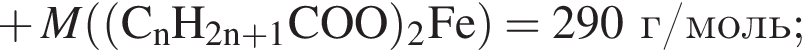
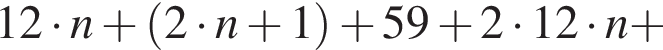
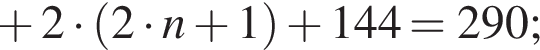
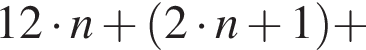
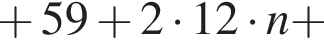

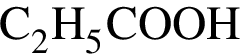 — пропионовая.
— пропионовая. , содержащие тройную связь между атомами углерода.
, содержащие тройную связь между атомами углерода.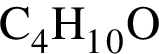 . Такую же формулу имеет бутанол-1.
. Такую же формулу имеет бутанол-1. 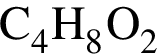 . Такую же формулу имеет бутановая кислота.
. Такую же формулу имеет бутановая кислота.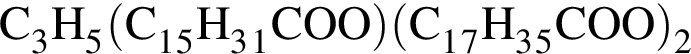 , молярная масса которого M = 862 (г/моль).
, молярная масса которого M = 862 (г/моль).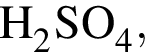
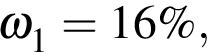
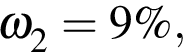 100 г.
100 г. 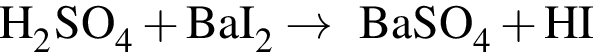
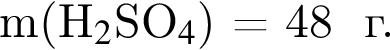
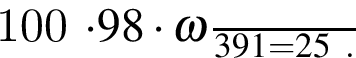
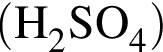
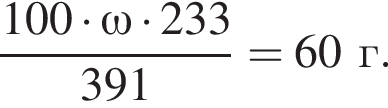
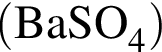
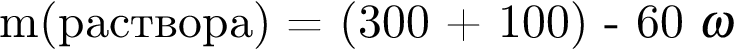
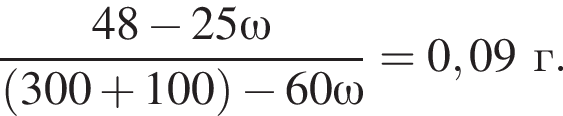

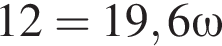
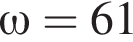
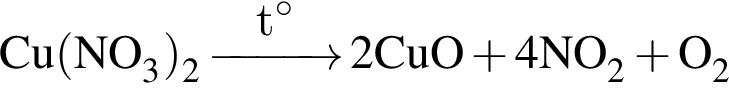
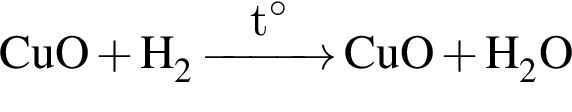

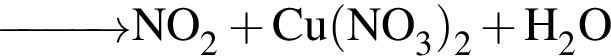 ,
, 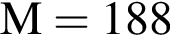
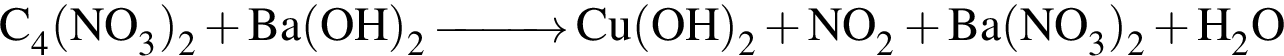
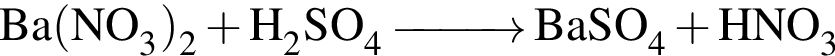 ,
, 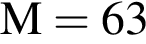
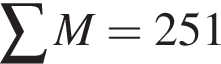
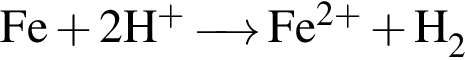 . Сумма коэффициентов — 5.
. Сумма коэффициентов — 5.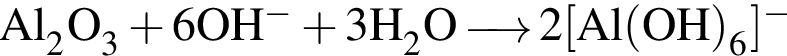 . Сумма коэффициентов — 12.
. Сумма коэффициентов — 12.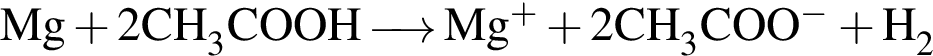 . Сумма коэффициентов − 7.
. Сумма коэффициентов − 7.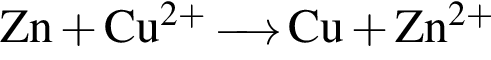 . Сумма коэффициентов − 4.
. Сумма коэффициентов − 4.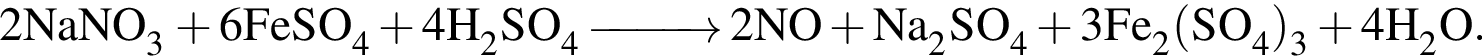
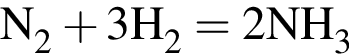 ;
;